Das wellenmechanische, nichtrelativistische Modell Erwin Schrödingers ermöglicht es, das Wasserstoffatom mathematisch zu beschreiben und eine sehr gute Näherung für die Energieeigenwerte des Elektrons im Coulombfeld des Protons zu berechnen.
Dazu geht man von der Schrödingergleichung
![]()
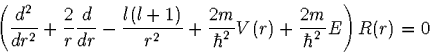 |
(1) |
Da es sich beim Wasserstoffatom um ein Zweikörperproblem handelt, muß für m
die reduzierte Masse von Proton und Elektron eingesetzt werden.
Diese ergibt sich zu ![]() kg.
Die entsprechende Ruheenergie beträgt rund
kg.
Die entsprechende Ruheenergie beträgt rund ![]() eV.
Für das Potential V(r) setzt man das Coulompotential des Protons
eV.
Für das Potential V(r) setzt man das Coulompotential des Protons
![]() ein.
Die Separationskonstante l kann als Drehimpulsquantenzahl des Elektrons
interpretiert werden und E als Gesamtenergie des Elektrons.
ein.
Die Separationskonstante l kann als Drehimpulsquantenzahl des Elektrons
interpretiert werden und E als Gesamtenergie des Elektrons.
Eine genauere Untersuchung der radialen Schrödingergleichung zeigt, daß man analytische Lösungen von der Form
| |
(2) |
erhält.
Al ist eine Normierungskonstante, die die Interpretation von
![]() als Aufenthaltswahrscheinlichkeit ermöglicht, indem sie die
Wellenfunktion auf 1 normiert. L sind die Laguerre-Polynome, die gemäß
als Aufenthaltswahrscheinlichkeit ermöglicht, indem sie die
Wellenfunktion auf 1 normiert. L sind die Laguerre-Polynome, die gemäß
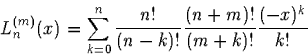
definiert sind. Die asymptotische Lösung ist
| |
(3) |
Um die Differentialgleichung (1) einer numerischen Behandlung leichter zugänglich zu machen, formt man sie ein wenig um. Das Ziel ist es, möglichst einfache Ausdrücke zu erhalten, die etwa von der Größenordnung 1 sind, damit bei Summationen möglichst wenige Mantissenstellen verlorengehen und keine Auslöschungseffekte auftreten. Dazu wird eine neue Funktion ul(r)=r R(r) definiert und einige Summanden der daraus folgenden Differentialgleichung mit c2 erweitert:
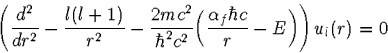 |
(4) |
Als ,,natürliche`` Einheiten bei der Untersuchung des Wasserstoffatoms eignen
sich Elektronvolt als Einheit der Energie und Nanometer als Einheit der Länge.
Für mc2 kann man somit ![]() eV einsetzen und
eV einsetzen und
![]() ergibt sich zu 197,327054065 eVnm.
Die Sommerfeldsche Feinstrukturkonstante
ergibt sich zu 197,327054065 eVnm.
Die Sommerfeldsche Feinstrukturkonstante ![]() hat den Wert
1/137,0359895.
hat den Wert
1/137,0359895.